>半導体性を有する固体触媒に、外部から電位を与えることで、アンモニアを、窒素と水素から作る反応が
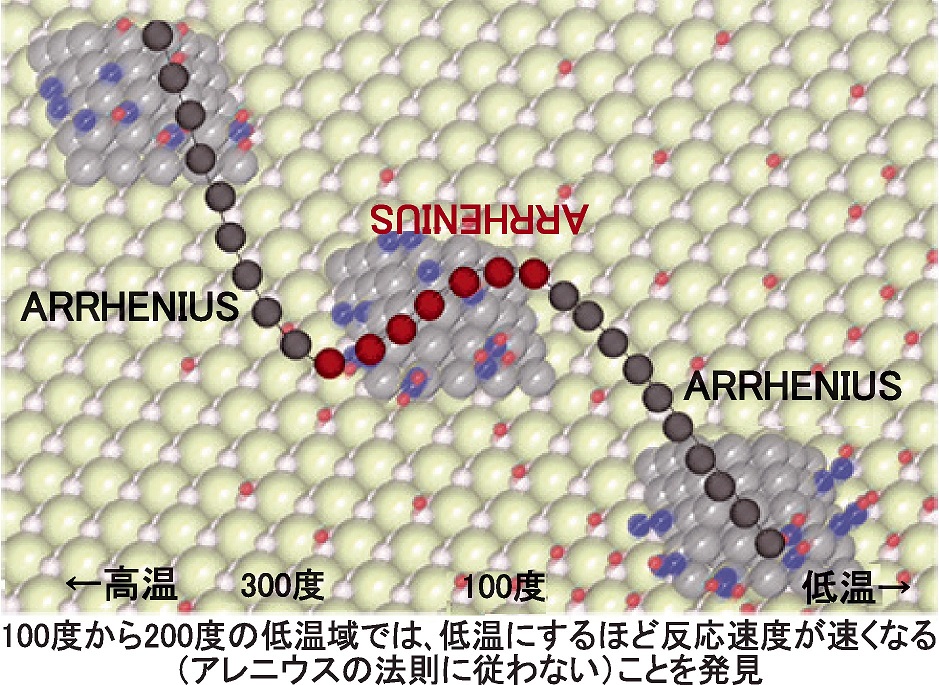
>200度以下の領域では、温度を下げたほうが反応速度が速くなる
>触媒表面でイオンが動く際に、吸着が多くなる低温で反応速度が速くなる電位により、活性化自由エネルギーの障壁を下げることは、ありがちな話だが
低温で、触媒表面で吸着が多くなると、さらに効率が上がる物理モデルは興味深い
https://pubs.rsc.org/en/content/articlehtml/2020/cc/d0cc00482k
H +マイグレーションによって引き起こされる抗アレニウス低温不均一触媒作用の重要な要素:サポート上のH +カバレッジ†
村上幸太 a、 田中裕太 a、 酒井竜也 a、 久居勇大 a、 林春日 a、 水谷裕太 a、 琢磨肥後 、 周平大胡 、 チョンギルソ B、 英明Tsuneki と 泰関根 * 応用化学、早稲田大学、3-4-1、大久保、新宿、東京の169から8555まで、日本の教室。メール:ysekine@waseda.jp bORCIDロゴORCIDロゴORCIDロゴ ORCIDロゴ
449449-728京畿道龍仁市チョイン区ナムドン南京明洞大学エネルギー科学技術部 2020年1月18日受領 、2020年2月25日承認
2020年3月13日に初版 電場における低温不均一触媒反応は、オンデマンドの小規模触媒プロセスの新しいアプローチとして期待されています。このレポートは、抗アレニウス挙動を示す、電場での触媒アンモニア合成の触媒担体におけるプロトン被覆の重要な役割を定量的に明らかにします。 過去数十年の間に、工業触媒プロセスは大規模プロセス向けに最適化されてきました。熱交換器などの各種設備を利用し、過酷な条件(高温・高圧)下でも効率よく稼働します。しかし、持続可能な社会を支える次世代の触媒プロセスでは、より穏やかな条件下で稼働する小規模プラントがオンサイトおよびオンデマンドでの稼働が期待されています。触媒の作動条件を緩和するために、外部刺激(例えば、光、磁場、および電場)を使用した触媒反応が大きな注目を集めています。1〜8低温触媒作用のための電場の使用を特に検討した私たちのグループは、炭化水素の水蒸気改質、メチルシクロヘキサン(MCH)の脱水素、およびNH 3合成などのさまざまな触媒反応を促進しました。9–23電場では、表面ヒドロキシル基を介した H +ホッピングが進行し(いわゆる表面プロトニクス)、CH 4、MCH、N などの担持金属上のH +吸着剤との衝突による反応経路が可能になります2。
さまざまな分析により、H +ホッピングによって誘導される電場における定性的に新しい触媒作用が明らかになりました。9–23全体的な反応速度に対するH +の寄与の定量的評価は非常に重要です。ここに記載された研究は、モデル反応および触媒としてそれぞれNH 3合成およびRu / CeO 2を使用して、電場中の担体上のH +量の効果を定式化することに成功した。 この研究では、CeO 2(JRC-CEO-01)を担体として含浸法を使用して1 wt%Ru / CeO 2を調製しました。さまざまな触媒床温度で電場(6 mA直流)とH 2分圧(P H 2)を使用すると、NH 3合成速度(r)への影響が観察されました。すべての活性試験の前に、触媒は一般的な条件(N 2:H 2 = 1 :3(P H 2 = 0.75 atm)、723 K、2時間)であらかじめ還元されていました。固定床型反応器の模式図を図S1に示す(ESI †[薄いスペース(1 / 6-em)][薄いスペース(1 / 6-em)][薄いスペース(1 / 6-em)][薄いスペース(1 / 6-em)])。触媒床温度は、触媒粒子に取り付けられた熱電対を使用して直接検出され、印加された電流によって引き起こされる反応に対するジュール熱の影響を排除しました。 電場がない場合、従来型のアレニウスプロットが得られました(図1(a)の白抜きの記号)。対照的に、電場は、NH 3合成率の完全に異なる温度依存性を誘発しました(図1(a)および表S1、S2、ESI †の閉じた記号)。従来のアレニウスのような振る舞いは、高温領域(573–673 K)で検出されました。ただし、勾配は温度の低下とともに減少しました。また、抗アレニウス様の振る舞いが373〜573 K付近に現れた。その後、アレニウスに似た振る舞いが373 K付近よりも低い温度で再び確認された。P H 2依存性はこの仮定をサポートしました(図1(b)および表S3–S6、ESI †)。反アレニウスのような挙動が観察された373〜573 K付近では、P H 2は反応速度にプラスの影響を及ぼしますが、他の温度領域では反応速度がわずかに変化しました。従来、Ruベースの触媒は、Ru表面でのH 2被毒のため、P H 2に負の依存性を示します。24–26 CeO 2を担体として使用すると、Ru表面からCeO 2へのH原子のスピルオーバーにより、被毒が抑制されます。27日電場がない場合、P H 2の増加に伴う活動のわずかな変化も確認されました(図S2、ESI †)。したがって、Ru / CeO 2よりも高いP H 2による活性の強化は、電場における完全に特異的な傾向であり、新しい反応メカニズムを示しています。
画像ファイル:d0cc00482k-f1.tif
図 1 1 wt%Ru / CeO 2におけるNH 3合成速度(r)のアレニウスプロット:(a)P H 2 = 0.75 atmでの電界あり/なし(0または6 mA)。(b)6 mAの電界(0.58、0.67、および0.75 atm)におけるP H 2依存性。
伝えられるところによると、従来のアンモニア合成は、供給されたN 2が直接解離する「解離メカニズム」を介して進行します。28
N 2 →2N ad (1)
H 2 →2H ad (2)
N ad + 3H ad →NH 3(g) (3)
しかし、最近、私たちは、電界中のアンモニア合成はN「連想メカニズム」を通じて進行することが推測されている2 Hに関連付け+解離前の担体上。19
H 2 →2H ad (4)
H ad →H + ad + e − (5)
N 2ad + H + ad + e − →N 2 H ad (6)
N 2 H ad + H + ad + e − →N 2 H ad (7)
N 2 H 2ad + H + ad + e − →N ad + NH 3(g) (8)
ここで、「ad」は吸着種を示し、「g」は気体種を示します。さらに、N x H y(x = 0–2、y = 0–2)は担持金属に吸着し、H +は担体の格子酸素(O lat)に吸着します。同様に、プロトンを支持体上でホッピングすることによるC–H切断活性化を報告しました。9–18したがって、担体上のH +の量は、電場での新しい触媒作用にとって非常に重要であると予想されます。したがって、CeO 2に対するH +カバレッジの温度依存性を仮定しました。 電場の特定の温度依存性に重要な役割を果たします。
この仮説を定量的に解明するために、P H 2 = 0.75 atm でのO lat上でのH +カバレッジの温度依存性を、電場とDRIFTなしの伝送モードでのin situ FT-IR測定(図2(a))を使用して調査しました電界あり/なしのモード(図2(b))。水素吸着エネルギーオーバーO LAT(H +の安定性は、オーバーO LAT)NHための根本的に重要であった3電界の合成速度。19測定セル外の大気H 2 Oの影響を除外するには、D反応物として2が供給された。また、O lat -D +伸縮ピーク(約2780 cm -1) 29を使用して、各温度でのH +量の疑似定量分析を行いました。詳細な測定手順を図S3(ESI †)に示します。透過モードのIRセルは、表面のOHグループの定量的調査に適しています(図2(c))一方、電界はその構造のためにセルに適用できません。そのため、表面のOHグループの量に対する電界の影響を評価するために、DRIFTも測定しました(DRIFTでは、その原理により正確な定量的な量を評価できないことに注意してください)。電場を用いた定性分析(図2(b))により、電場の印加による大きな変化は見られなかった。電場の印加は少量のジュール熱を生成するため、小さな変化を観察できますが、吸着に対する気相温度(つまり、323 Kと473 Kの差)の影響ははるかに大きくなります。
画像ファイル:d0cc00482k-f2.tif
図2 N 2 5 SCCMおよびD 2 15 SCCM 下の1 wt%Ru / CeO 2を超えるO lat -D +の定量分析:(a)in situ IR透過スペクトル、(b)in situ IR DRIFTsスペクトルあり/なしEF、および(c)透過スペクトルによる相対カバレッジ(θ(T)= Area(T)/ Area(323 K))。
ピーク面積を使用してH +(θ(T))の相対カバレッジを計算しました。ここで、323 Kでの値(面積(323 K))を基準として使用しました(eqn(9))。
θ(T)=面積(T)/面積(323 K) (9)
結果は、H +カバレッジが温度の増加とともに減少することを明らかにしました(図2(c))。また、323から373 Kで、H +のカバレッジは、Hの飽和を示す、わずかに変更+カバレッジを。
得られたθ(T)は、電場内の特定のアレニウスプロットに対する温度に対するH +カバレッジ依存性の寄与を示唆しています。触媒床温度が573 Kより高い場合、CeO 2よりもH +の減少により、NH 3合成速度の加速は無視できるほどになります。つまり、高温領域でのNH 3合成は、従来の「解離メカニズム」を介して進行します。図2は、O lat -D +高温域でもある程度表面に残ったが、以下の理由により影響は小さくなった。まず、「解離メカニズム」による反応は高温領域で非常に活発です。さらに、「解離メカニズム」は金属表面のすべての領域で進行する可能性がありますが、「会合メカニズム」は3相境界(TPB)22で制限されます。これは、「解離メカニズム」の反応サイトが「会合メカニズム」の反応サイトよりもはるかに大きいことを意味します。そのため、支持体上にプロトンが存在していても、高温領域では全体的な反応速度に対する「会合メカニズム」の寄与が非常に小さくなります。対照的に、CeO 2表面はH +で覆われています373 Kより低い温度で十分。また、H +はRu上でN 2と反応します。約373〜573 Kでの全体的な反応速度は、「解離メカニズム」と「結合メカニズム」による2つの反応速度の合計として説明できます。したがって、電場における全体的なNH 3合成率は次のように定義できると仮定しました。
r calc(T)= r 解離性(T)+ θ(T)× r 結合性(T) (10)
ここで、r dissociative(T)とr associative(T)は外挿値を示します(図3)。電場のないアレニウスプロット(図1(a))は、r 解離性(T)に使用されます。r 連想性(T)は、低温(T 573 KまたはT 573 K or T < 373 K). Furthermore, PH2 dependence on the electric field was influenced by the temperature. The activities increase with high PH2 only around 373–573 K. The H+ coverage was detected using in situ FT-IR measurements in a transmission mode. The results of analysis showed that the increment of H+ coverage accorded to the temperature decrease. The coverage hits a ceiling at around 373 K. Based on the findings described above, the overall reaction rate in the electric field was formulated. The calculated reaction rate fitted closely to the experimental values. The linear relation between the H+ coverage and enhancement of the reaction rate by the electric field are indicated clearly. These insights are fundamentally important for the further investigation of catalytic reactions in the electric field. This study was supported by JST MIRAI. Conflicts of interest
The authors have no conflict to declare related to this paper.
Notes and references
A. Iwase and A. Kudo, Chem. Commun., 2017, 53, 6156–6159 RSC.
J. Xu, C. Pan, T. Takata and K. Domen, Chem. Commun., 2015, 51, 7191–7194 RSC.
F. Che, J. T. Gray, S. Ha and J. S. McEwen, ACS Catal., 2017, 7(10), 6957–6968 CrossRef CAS.
A. Yamamoto, S. Mizuba, Y. Saeki and H. Yoshida, Appl. Catal., A, 2016, 521, 125–132 CrossRef CAS.
M. Iwamoto, M. Akiyama, K. Aihara and T. Deguchi, ACS Catal., 2017, 7, 6924–6929 CrossRef CAS.
Y. Kobayashi, N. Shimoda, Y. Kimura and Y. Satokawa, ECS Trans., 2017, 75(42), 43–52 CrossRef CAS.
L. Zhang, L. X. Ding, G. F. Chen, X. Yang and H. Wang, Angew. Chem., Int. Ed., 2019, 58, 2612–2616 CrossRef CAS PubMed.
T. Nozaki, N. Muta, S. Kado and K. Okazaki, Catal. Today, 2004, 89(1–2), 57–65 CrossRef CAS.
M. Torimoto, K. Murakami and Y. Sekine, Bull. Chem. Soc. Jpn., 2019, 92(10), 1785–1792 CrossRef CAS.
M. Torimoto, S. Ogo, D. Harjowinoto, T. Higo, J. G. Seo, S. Furukawa and Y. Sekine, Chem. Commun., 2019, 55, 6693–6695 RSC.
S. Okada, R. Manabe, R. Inagaki, S. Ogo and Y. Sekine, Catal. Today, 2018, 307, 272–276 CrossRef CAS.
R. Manabe, S. Okada, R. Inagaki, K. Oshima, S. Ogo and Y. Sekine, Sci. Rep., 2016, 6, 38007 CrossRef CAS PubMed.
T. Yabe, K. Yamada, T. Oguri, T. Higo and Y. Sekine, ACS Catal., 2018, 8, 11470–11477 CrossRef CAS.
R. Inagaki, R. Manabe, Y. Hisai, Y. Kamite, T. Yabe, S. Ogo and Y. Sekine, Int. J. Hydrogen Energy, 2018, 43(31), 14310–14318 CrossRef CAS.
K. Takise, A. Sato, K. Muraguchi, S. Ogo and Y. Sekine, Appl. Catal., A, 2019, 573, 56–63 CrossRef CAS.
M. Kosaka, T. Higo, S. Ogo, J. G. Seo, K. Imagawa, S. Kado and Y. Sekine, Int. J. Hydrogen Energy, 2020, 45(1), 738–743 CrossRef CAS.
K. Takise, A. Sato, S. Ogo, J. G. Seo, K. Imagawa, S. Kado and Y. Sekine, RSC Adv., 2019, 9, 27743–27748 RSC.
K. Takise, A. Sato, K. Murakami, S. Ogo, J. G. Seo, K. Imagawa, S. Kado and Y. Sekine, RSC Adv., 2019, 9, 5918–5924 RSC.
K. Murakami, Y. Tanaka, S. Hayashi, R. Sakai, Y. Hisai, Y. Mizutani, A. Ishikawa, T. Higo, S. Ogo, J. G. Seo, H. Tsuneki, H. Nakai and Y. Sekine, J. Chem. Phys., 2019, 151, 064708 CrossRef.
K. Murakami, Y. Tanaka, R. Sakai, K. Toko, K. Ito, A. Ishikawa, T. Higo, T. Yabe, S. Ogo, M. Ikeda, H. Tsuneki, H. Nakai and Y. Sekine, Catal. Today DOI:10.1016/j.cattod.2018.10.055.
K. Murakami, R. Manabe, H. Nakatsubo, T. Yabe, S. Ogo and Y. Sekine, Catal. Today, 2018, 303, 271–275 CrossRef CAS.
A. Gondo, R. Manabe, R. Sakai, K. Murakami, T. Yabe, S. Ogo, M. Ikeda, H. Tsuneki and Y. Sekine, Catal. Lett., 2018, 148(7), 1929–1938 CrossRef CAS.
R. Manabe, H. Nakatsubo, A. Gondo, K. Murakami, S. Ogo, H. Tsuneki, M. Ikeda, A. Ishikawa, H. Nakai and Y. Sekine, Chem. Sci., 2017, 8, 5434–5439 RSC.
K. Aika, A. Ohya, A. Ozaki, Y. Inoue and I. Yasumori, J. Catal., 1985, 92, 305–311 CrossRef CAS.
H. Bielawa, O. Hinrichsen, A. Birkner and M. Muhler, Angew. Chem., Int. Ed., 2001, 40(6), 1061–1063 CrossRef CAS PubMed.
S. E. Siporin and R. J. Davis, J. Catal., 2004, 225, 359–368 CrossRef CAS.
Y. Niwa and K. Aika, Chem. Lett., 1996, 3–4 CrossRef CAS.
K. Honkala, A. Hellman, I. N. Remediakis, A. Logadottir, A. Carlsson, S. Dahl, C. H. Christensen and J. K. Nørskov, Science, 2005, 307, 555–558 CrossRef CAS PubMed.
K. Werner, X. Weng, F. Calaza, M. Sterrer, T. Kropp, J. Paier, J. Sauer, M. Wilde, K. Fukutani, S. Shaikhutdinov and H. J. Freund, J. Am. Chem. Soc., 2017, 139(48), 17608–17616 CrossRef CAS PubMed.
Footnote
† Electronic supplementary information (ESI) available. See DOI: 10.1039/d0cc00482k
|
 スパムメールの中から見つけ出すためにメールのタイトルには必ず「阿修羅さんへ」と記述してください。
スパムメールの中から見つけ出すためにメールのタイトルには必ず「阿修羅さんへ」と記述してください。